La autofagia es un proceso que
forma parte de la dinámica celular, mediante el cual se renuevan las
proteínas y organelas, con la ayuda de los lisosomas. En una
revisión recientemente publicada (Son et al., 2012) se reúnen los
últimos hallazgos que relacionan estos procesos con la Neurodegeneración.
La integridad que presentan las
neuronas post-mitóticas depende, en su mayor parte, de la autofagia basal,
comparado con los que ocurre en otros tipos celulares. Esto se debe a que en
las neuronas las proteínas mal plegadas y los orgánulos dañados no pueden
“diluirse” mediante la división celular, ya que su estado de diferenciación
impide la entrada en mitosis.
Además, la función neuronal depende del tráfico celular
a través de los axones neuronales de proteínas, vesículas y autofagosomas, por
lo que los defectos de autofagia contribuirían de forma significativa a la
neurodegeneración. Estas alteraciones se han descrito en la enfermedad
de Parkinson (PD), de Alzheimer (AD), de Huntington (HD) y en la esclerosis
lateral amiotrófica.
 Sin embargo, existe una gran
controversia acerca de si el aumento de la autofagia en las neuronas de un
paciente que padece una enfermedad neurodegenerativa es una causa directa de
este proceso o si, por el contrario, juega un papel protector.
Sin embargo, existe una gran
controversia acerca de si el aumento de la autofagia en las neuronas de un
paciente que padece una enfermedad neurodegenerativa es una causa directa de
este proceso o si, por el contrario, juega un papel protector. Las neuronas presentan estructuras altamente especializadas para la comunicación intercelular (dendritas, soma, axón y sinapsis neuronal). En el soma de estas células se mantiene la homeostasis celular gracias a los procesos de macroautofagia, microautofagia y autofagia mediada por chaperonas (proteínas que colaboran con el plegamiento correcto de otras). El axón, especializado en la conducción del impulso nervioso, es también zona de paso de proteínas y organelas gracias al transporte axoplásmico. La alteración de este proceso conduce a la acumulación de autofagosomas y formación de vacuolas autofágicas (AVs), las cuales se han observado en pacientes con Alzheimer, Parkinson y Huntington. La región de contacto entre el axón de una neurona y las dendritas de otra se conoce como sinapsis neuronal y requiere de un correcto turnover proteico y representa una elevada demanda energética. En esta región celular las señales ambientales incrementan los procesos de autofagia, implicados en el desarrollo de las sinpasis.
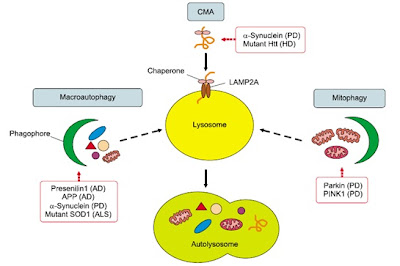 En la mayor parte de enfermedades neurodegenerativas se ha descrito algún proceso que altera de autofagia. En la enfermedad
de Alzheimer se acumula el péptido beta-amiliode generado por escisión
proteolítica de la proteína precursora (APP), AVs intracelulares y placas de
amiloide en el cerebro. La presencia de presenilina 1 (PS1) mutante impide la
renovación autofagosómica, lo cual incrementa la acumulación del beta-amiloide.
La enfermedad de Parkinson se caracteriza por la presencia de los
cuerpos de Lewy, inclusiones intracitoplasmáticas de alfa-sinucleina, que
normalmente se degrada por macroautofagia y autofagia dependiente de
chaperonas. Además, en la patogénesis de esta enfermedad participan también las
mitocondrias dañadas acumuladas debido a la disfunción de los procesos de
autofagia correspondientes a estos orgánulos (mitofagia).
En la mayor parte de enfermedades neurodegenerativas se ha descrito algún proceso que altera de autofagia. En la enfermedad
de Alzheimer se acumula el péptido beta-amiliode generado por escisión
proteolítica de la proteína precursora (APP), AVs intracelulares y placas de
amiloide en el cerebro. La presencia de presenilina 1 (PS1) mutante impide la
renovación autofagosómica, lo cual incrementa la acumulación del beta-amiloide.
La enfermedad de Parkinson se caracteriza por la presencia de los
cuerpos de Lewy, inclusiones intracitoplasmáticas de alfa-sinucleina, que
normalmente se degrada por macroautofagia y autofagia dependiente de
chaperonas. Además, en la patogénesis de esta enfermedad participan también las
mitocondrias dañadas acumuladas debido a la disfunción de los procesos de
autofagia correspondientes a estos orgánulos (mitofagia).
Por su parte, en la enfermedad
de Huntington se han observado la presencia de inclusiones compuestas por
fragmentos N-terminales de la proteína hungtintina mutada, lo cual se ha
relacionado con un defecto en la habilidad de las vacuolas autofágicas de
reconocer la carga citosólica. En cuanto a la esclerosis lateral amiotrófica
o ALS, las mutaciones de SOD1 suponen el 20% de los casos de ALS familiar.
Se ha comprobado que los agentes que promueven la autofagia (como el litio o la
rapamicina) ayudan a la eliminación de SOD1 mutada.
Los modelos de enfermedad de
Huntington han demostrado un incremento en estadíos tempranos de la
enfermedad de las AVs y la autofagia, lo cual puede ser una muestra del intento
de las células de eliminar la huntingtina mutada. Con el tiempo, la maquinaria
autofágica se vuelve disfuncional. Por ello, la inducción terapeútica y la
recuperación de la autofagia puede mejorar el aclaramiento de la proteína
mutada en estos pacientes, lo cual reduciría su efecto tóxico en las neuronas.